Carbon ke aprup: आज हम कार्बन के अपरूप (Allotropes of Carbon) के बारे में जानेंगे। वास्तव में, अपरूप के बजाय अपररूप अधिक सही हैं। उसी प्रकार, अपरूपता का जगह अपररूपता ज्यादा उपयुक्त हैं।
अपरूप क्या होता है और अपरूपता किसे कहते हैं?
प्रकृति में कोई भी तत्व एक से अधिक रूपों में पाया जाता हैं। इन्हें अपरूप कहते हैं। जिस गुण या घटना के कारण कोई तत्व एक से अधिक रूपों में पाया जाता हैं, उसे अपरूपता कहा जाता हैं।
किसी भी तत्व के अपरूप का रासायनिक गुण तत्व के रासायनिक गुण के सामान होता हैं परन्तु भौतिक गुण अलग-अलग होते हैं। इनकी संरचना भी अलग होती हैं। ये मूल तत्व के परमाणुओं से बने होते हैं। ये तत्व के शुद्ध रूप माने जाते हैं।
कार्बन के अपरूप (Allotropes of Carbon)
Carbon ke aprup: प्रकृति में कार्बन अनेक रूपों में पाया जाता हैं। इन्हें कार्बन के अपरूप कहते हैं। हीरा, ग्रेफाइट और फुलेरीन कार्बन के तीन प्रमुख अपरूप हैं।
हीरा, ग्रेफाइट और फुलेरीन कार्बन के ही परमाणु से बने होते हैं। किन्तु इनके गुण अलग-अलग होते हैं। अपरूपों में कार्बन के परमाणु आपस में अलग-अलग तरीके से आबंधित होते हैं जिस कारण इनके गुण अलग-अलग होते हैं। आगे हम इन तीनों के गुणों और संरचनाओं के बारे में विस्तार से जानेंगे।
कार्बन के अपरूपों को दो भागों में बाँटा जाता हैं -
I) क्रिस्टलीय अपरूप या रवेदार अपरूप (Crystalline Allotropes)
II) अक्रिस्टलीय अपरूप या बेरवेदार अपरूप (Amorphous Allotropes)
I) क्रिस्टलीय अपरूप: कार्बन के वे अपरूप जिनमे कार्बन परमाणु निश्चित रूप से व्यवस्थित होते हैं एवं जिनकी एक निश्चित संरचना होती हैं, उन्हें क्रिस्टलीय अपरूप कहा जाता हैं। उदाहरण - हीरा, ग्रेफाइट और फुलेरीन कार्बन के क्रिस्टलीय अपरूप हैं।
II) अक्रिस्टलीय अपरूप: कार्बन के वे अपरूप जिनकी कोई निश्चित संरचना या ज्यामिति नही होती हैं, उन्हें अक्रिस्टलीय अपरूप कहते हैं। इनमे कार्बन के परमाणु अनिश्चित रूप से व्यवस्थित होते हैं। उदाहरण - कोल, कोक, काष्ठ, चारकोल, काजल इत्यादि।
हीरा (Diamond)
हीरा कार्बन का क्रिस्टलीय अपरूप हैं। यह कार्बन का एक अतिशुद्ध रूप हैं।
हीरे का प्राकृतिक स्त्रोत किम्बरलाइट पत्थर हैं। हीरा विश्व में अफ्रीका, ब्राजील, USA, ऑस्ट्रेलिया आदि देशों में पाया जाता हैं। भारत में गोलकुण्डा, अनन्तपुर, बेलारी, पन्ना आदि स्थानों पर हीरा मिलता हैं।
हीरे की संरचना
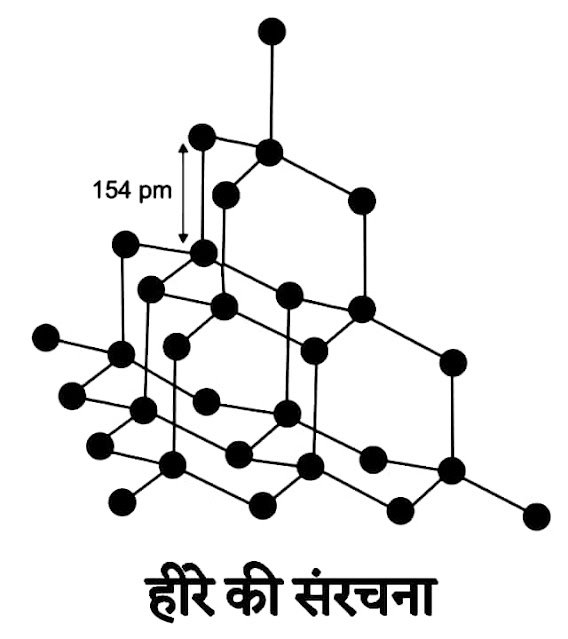
हीरे में कार्बन का प्रत्येक परमाणु चार अन्य परमाणुओं से आबंधित होता हैं। इसके कारण ये दृढ़ एवं त्रिआयामी संरचना का निर्माण करते है। इसकी संरचना नियमित चतुष्फलकीय (Regular Tetrahedral) होती हैं। हीरे में दो कार्बन परमाणु के बीच की दूरी 0.154 nm होती हैं।
हीरे का गुण
शुद्ध हीरा पारदर्शक एवं रंगहीन होता हैं, किन्तु अशुद्धियों की उपस्थिति के कारण यह भिन्न-भिन्न रंगो में पाया जाता है।
यह सभी पदार्थों से कठोर होता हैं। यह काँच को आसानी से काट देता है। यह किसी द्रव में नही घुलता है। इस पर अम्ल, क्षार आदि का कोई प्रभाव नहीं पड़ता है।
हीरा विद्युत और ताप का का कुचालक होता हैं।
हीरा का उपयोग
- हीरे का उपयोग आभूषण बनाने में होता है।
- काला हीरा (जिसे बोर्ट कहते हैं) का उपयोग काँच काटने, चट्टानों में छेद करने और पत्थरो पर पॉलिश करने में होता हैं।
ग्रेफाइट (Graphite)
ग्रेफाइट कार्बन का एक क्रिस्टलीय अपरूप है जो काफी उपयोगी होता हैं। पेंसिल की लीड ग्रेफाइट से बनी होती है।
Graphite शब्द की उत्पत्ति ग्रीक शब्द Graphein से हुई है जिसका शाब्दिक अर्थ होता है - लिखना।
ग्रेफाइट की संरचना

ग्रेफाइट में कार्बन का प्रत्येक परमाणु तीन अन्य परमाणुओं के साथ संयोजित होता है जो षट्कोणीय वलय संरचना का निर्माण करते हैं। ग्रेफाइट में सभी षट्कोणीय तल एक दूसरे के ऊपर व्यवस्थित होते हैं। इनकी संरचना परतदार होती है।
इनके दो परतों के बीच दुर्बल बंध होने के कारण वे एक दूसरे पर फिसल सकते हैं। इसी कारण से ग्रेफाइट का प्रयोग शुष्क स्नेहक (Dry Lubricant) के रूप में किया जाता है।
ग्रेफाइट का गुण
ग्रेफाइट चमकदार, अपारदर्शी एवं काले रंग का होता है।
ग्रेफाइट विद्युत् और ताप का सुचालक होता हैं। ग्रेफाइट में एक कार्बन परमाणु तीन कार्बन परमाणुओं से संयोजित होता है। इस कारण इनमे मुक्त इलेक्ट्रॉन पाया जाता है। मुक्त इलेक्ट्रॉन की उपस्थिति के कारण यह विद्युत का सुचालक होता है।
कागज पर रगड़ने से यह उस पर निशान बना देता है। इस कारण इसे काला सीसा (Black Lead) भी कहते हैं।
ग्रेफाइट का उपयोग
- पेंसिल का लीड बनाने में
- ग्रेफाइट चूर्ण का इस्तेमाल मशीनों में शुष्क स्नेहक (Dry Lubricant) के रूप में होता है।
- शुष्क सेलों (Dry Cells) और विद्युत अपघटन क्रियाओं में इलेक्ट्रोड (Electrode) के रूप में
- कृत्रिम हीरा बनाने में: काफी उच्च दाब पर उत्प्रेरक की उपस्थिति में ग्रेफाइट को गर्म करने पर यह हीरा में परिवर्तित हो जाता हैं।
- नाभिकीय परमाणु भट्टी में मंदक के रूप में
- लोहे की वस्तुओं पर पॉलिश करने में
- धातुओं को गलाने के लिए प्रयुक्त होने वाले 'उच्च तापसर क्रूसिबल' (Refractory crucibles) के निर्माण में
फुलेरीन (Fullerene)
फुलेरीन प्राकृतिक रूप से पाया जाने वाला कार्बन का एक अपरूप हैं। फुलेरीन में कार्बन के परमाणु फुटबॉल जैसी संरचना के रूप में व्यवस्थित होते है।
कार्बन के इस अपरूप का नाम अमेरिका के प्रसिद्ध वास्तुकार बकमिंस्टर फुलेरीन के नाम पर पड़ा हैं।
C20, C60, C70 इत्यादि सामान्य रूप से पाए जाने वाले फुलेरीन है। इनके एक परमाणु में 20, 60, 70 या इससे भी अधिक कार्बन परमाणु हो सकते हैं।

C60 एक अधिक स्थायी संरचना हैं। इसमें कुल 32 फलक होते है जिनमें 20 फलक षट्कोणीय एवं 12 फलक पंचकोणीय होते हैं। यह विद्युत का कुचालक होता हैं।
फुलेरीन का उपयोग
- उत्प्रेरक के रूप में
- प्राकृतिक गैसों के शुद्धिकरण में
- उच्च ताप पर अतिचालकता में
- आण्विक बेयरिंग में
- चिकित्सा के क्षेत्र में: Antioxidant, Antiviral Agent आदि के रूप में
उम्मीद है अब आप कार्बन के अपरूप (Allotropes of Carbon): हीरा, ग्रेफाइट और फुलेरीन के बारे में अच्छी तरह से जान गए होंगे।
